La velocidad de reacción: un ejemplo práctico
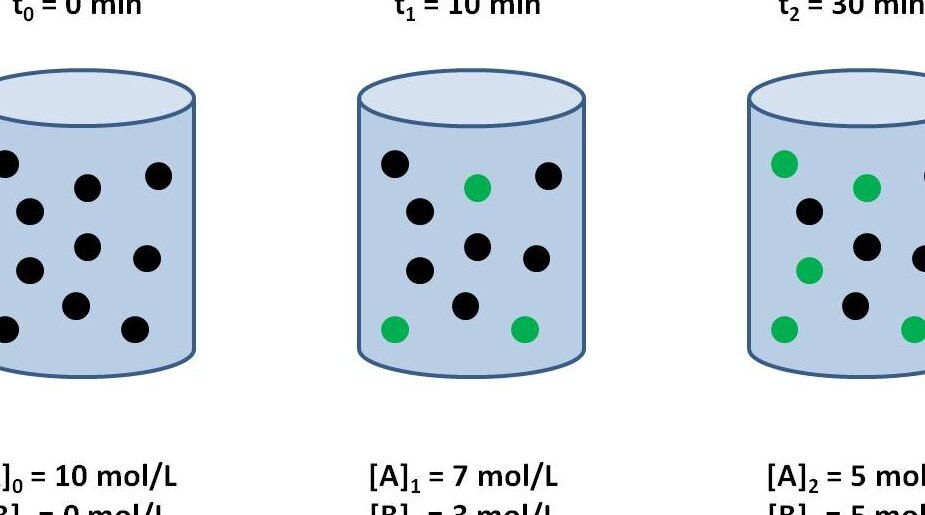
La velocidad de reacción es un concepto fundamental en la química y se refiere a la rapidez con la que ocurre una reacción química. Es importante comprender este concepto para poder predecir cómo se comportan las sustancias en una reacción y cómo se pueden modificar dichas velocidades.
¿Qué es la velocidad de reacción?
La velocidad de reacción se define como la medida de la variación de la concentración de los reactivos o productos en función del tiempo. En otras palabras, es la rapidez con la que las sustancias se transforman en una reacción química.
Ejemplo de velocidad de reacción
Imaginemos que tenemos una reacción química simple entre dos sustancias: el ácido clorhídrico (HCl) y el carbonato de calcio (CaCO3). La ecuación química de esta reacción es la siguiente:
HCl + CaCO3 → CaCl2 + CO2 + H2O
En este ejemplo, vamos a medir la velocidad de reacción observando la liberación de dióxido de carbono (CO2). Para ello, vamos a utilizar una balanza para medir el tiempo que tarda en liberarse una determinada cantidad de CO2.
En primer lugar, preparamos una solución de ácido clorhídrico y carbonato de calcio en un matraz de vidrio. A continuación, colocamos la balanza en cero y añadimos la solución al matraz. Comenzamos a medir el tiempo y observamos cómo la balanza registra un aumento de masa a medida que se libera CO2.
Después de transcurrido un tiempo determinado, detenemos la medición y registramos el tiempo que tardó en liberarse una cantidad específica de CO2. A partir de estos datos, podemos calcular la velocidad de reacción dividiendo la cantidad de CO2 liberada por el tiempo transcurrido.
Factores que afectan la velocidad de reacción
Existen varios factores que pueden influir en la velocidad de reacción, entre ellos:
- Concentración de los reactivos: a mayor concentración, mayor será la velocidad de reacción.
- Temperatura: un aumento en la temperatura suele acelerar la velocidad de reacción.
- Presión: en reacciones gaseosas, un aumento en la presión puede aumentar la velocidad de reacción.
- Catalizadores: ciertas sustancias pueden acelerar la velocidad de reacción sin ser consumidas en el proceso.
La velocidad de reacción es un concepto fundamental en la química y se puede medir experimentalmente utilizando diferentes métodos. En el ejemplo anterior, observamos cómo la liberación de dióxido de carbono nos permitió determinar la velocidad de reacción entre el ácido clorhídrico y el carbonato de calcio.
Es importante tener en cuenta que la velocidad de reacción puede ser afectada por diversos factores, como la concentración de los reactivos, la temperatura, la presión y la presencia de catalizadores.
Comprender la velocidad de reacción nos permite predecir cómo se comportarán las sustancias en una reacción química y cómo podemos modificar dichas velocidades para obtener los resultados deseados.

Entradas Relacionadas